Kinh Nghiệm Hướng dẫn Cách tính gam trong hóa học Chi Tiết
Họ và tên đang tìm kiếm từ khóa Cách tính gam trong hóa học được Cập Nhật vào lúc : 2022-03-29 04:31:12 . Với phương châm chia sẻ Bí kíp Hướng dẫn trong nội dung bài viết một cách Chi Tiết Mới Nhất. Nếu sau khi đọc tài liệu vẫn ko hiểu thì hoàn toàn có thể lại Comment ở cuối bài để Admin lý giải và hướng dẫn lại nha.Trong hóa học m là ký hiệu được sử dụng rất nhiều và phổ biến. Tuy nhiên, đối với những bạn mới lần đầu được tiếp xúc với công thức này chắc như đinh sẽ cảm thấy khá kinh ngạc. Vậy m là gì trong hóa học? Bài viết dưới đây tất cả chúng ta sẽ cùng nhau tìm hiểu sâu và kỹ hơn tới vấn đề này.
Nội dung chính- Tìm hiểu m là gì trong hóa họcTìm hiểu những công thức có liên quan đến molCông thức dùng để tính M (khối lượng Mol)Công thức tính m theo mol Công thức tính nồng độ molKhối lượng chất tan được tính theo công thức nào?Một số khái niệm cần nắm rõ trong hóa họcCác công thức hóa học lớp 8, 9 cơ bản cần nhớ Tổng hợp những công thức hóa học lớp 8 cần nhớ – chuyên đề 1 Công thức hóa học | Bài tập lập công thức hóa học nếu biết hóa trị1. Lập công thức của đơn chất2. Lập công thức của hợp chất3. Bài tập lập công thức Hóa HọcVideo liên quan
Tìm hiểu m là gì trong hóa học
Ký hiệu m trong hóa học được sử dụng vô cùng rất nhiều. Đây là ký hiệu của khối lượng mol trong một nguyên tố hoặc hợp chất hóa học. M được tính bằng đơn vị gam/mol. Đây là nguyên do m xuất hiện rất nhiều trong những công thức hóa học lúc bấy giờ.
Vậy m là gì trong hóa học? Những công thức hóa học nào có liên quan đến m? Chúng ta hãy tiếp tục theo dõi những thông tin hữu ích dưới đây.
Bạn đang xem: M trong hóa học là gì
Tìm hiểu những công thức có liên quan đến mol
Công thức dùng để tính M (khối lượng Mol)
Theo đó, tất cả chúng ta có công thức tính M như sau:
M = m/n
Trong số đó:
– M: là khối lượng mol
– m: là khối lượng của chất
– n: là số mol.
Công thức tính m theo mol
Để tính được m theo mol ta có công thức:
m= M x n
Trong số đó:
– m: là khối lượng của chất
– M: là khối lượng mol
– n: là số lượng mol
Từ đây tất cả chúng ta hoàn toàn có thể thực hiện tính được nồng độ phần trăm trong hóa học với việc ứng dụng những công thức sau đây:
Công thức 1:
C% = mct x 100% / mdd
Trong số đó:
– C%: là nồng độ phần trăm (%)
– mct: là khối lượng của chất tan được (gam)
– mdd: đây đó đó là khối lượng dung dịch (đơn vị gam)
Công thức 2:
C% = CM x M / 10 x D
Trong số đó:
– CM: là nồng độ mol, (Mol/lít)
– M: là khối lượng mol
– D: là khối lượng riêng (gam/ml).
Công thức tính nồng độ mol
Chúng ta có những công thức tính nồng độ mol như sau:
Công thức 1:
CM = nct / Vdd
Trong số đó:
– CM; là ký hiệu của nồng độ mol
– nct: là số mol chất tan
– Vdd: là thể tích của dung dịch (mililít)
Công thức 2:
CM = (10 x D x C%) / M
Trong số đó:
– M: là khối lượng mol
– C%: là nồng độ phần trăm (%)
– D: là khối lượng riêng (gam/ml)
Khối lượng chất tan được tính theo công thức nào?
Với khối lượng chất tan, ta tính theo công thức sau đây:
mct = (C% x Vdd) / 100%
Trong số đó:
– C%: là nồng độ phần trăm (%)
– Vdd: là ký hiệu của thể tích dung dịch (lít)
Công thức tính khối lượng riêng
D = mdd / Vdd(ml)
Trong số đó :
– D: là ký hiệu của khối lượng riêng của chất, có đơn vị là gam/ml
– mdd: để chỉ khối lượng dung dịch (gam)
– Vdd(ml): là thể tích dung dịch (mililít)
Một số khái niệm cần nắm rõ trong hóa học
Bên cạnh tìm hiểu m là gì trong hóa học? Trong hóa học có vô vàn những khái niệm rất khác nhau. Mỗi khái niệm, mỗi đặc điểm, tính chất sẽ được quy định với một công thức và một khái niệm rất khác nhau. Tuy nhiên, trong quá trình học hóa học chắc như đinh bạn sẽ gặp rất nhiều những khái niệm cơ bản như sau:
– Khái niệm về thể tích mol khí: thể tích mol khí là thể tích của chất khí bị chiếm bởi N phân tử.
Xem thêm: Mpeg 4 Part 14 (Mp4) Là Gì? Định Dạng Mp4 Là Gì ? So Sánh Mp3 Và Mp4: Sự Khác Biệt Là Gì
– Khái niệm nồng độ mol: Nồng độ mol (nồng độ mol dung dịch) nhằm mục đích cho tất cả chúng ta biết được số lượng mol chất tan tồn tại ở trong dung dịch, được ký hiệu là CM.
– Khái niệm khối lượng riêng (tỷ lệ khối lượng) đây là khái niệm dùng để chỉ những đặc tính tỷ lệ khối lượng có trong đơn vị của một vật chất.
– Khái niệm nồng độ phần trăm: Đây là khái niệm được dùng để chỉ khối lượng của chất tan (tính bằng gam) tồn tại trong 100g dung dịch. Ký hiệu của chúng là C%.
Những khái niệm này thường được sử dụng nhiều trong môn hóa. Cho nên, để học tốt bộ môn này, bạn hãy để ý quan tâm tới những khái niệm và những công thức hữu ích này.
Mathtype là gì? Hướng dẫn dùng mathtype đơn giản
Tìm hiểu về hiện tượng kỳ lạ phản xạ ánh sáng là gì?
Như vậy, những thông tin mà chúng tôi đã chia sẻ trên đây đã giúp bạn hiểu hơn về môn hóa nói chung và đồng thời trả lời được cho thắc mắc m là gì trong hóa học?
Hy vọng qua đây bạn sẽ hoàn toàn có thể tích lũy cho mình được những kiến thức và kỹ năng hữu ích phục vụ cho quá trình học tập, tìm hiểu của tớ. Chúc những bạn học thật tốt bộ môn thú vị này nhé.
1. Theo khối lượng:n = m/MTrong đó:m: khối lượngM: khối lượng phân tử, khối lượng molVí dụ 1Cho 2,4 gam Mg vào dung dịch HCl dư. Tính thể tích khí hiđrô thu được ở điều kiệnchuẩn. (Cho Mg=24)2. Theo thể tích (đối với chất khí ở điều kiện chuẩn) :n =V/22,4Trong đó:V: thể tích khíVí dụ 2Cho 6,75 gam sắt kẽm kim loại nhôm vào dung dịch H2SO4 loãng . Phản ứng xong thu được3,36 lít khí (đktc).a. Viết phương trình phản ứng.b. Tính khối lượng muối thu được sau phản ứng.
(Cho: Zn = 65; H = 1; S = 32; O = 16)
II. CÔNG THỨC TÍNH NỒNG ĐỘ DUNG DỊCH1. Nồng độ mol /lít (CM)
CM =n/V (M)

Ví dụ 3
Để trung hoà hết 200 gam dung dịch NaOH 10% cần dùng bao nhiêu gam dung dịch HCl 3,65%.
(cho Na = 23; Cl = 35,5; O = 16; H = 1)
Ví dụ 4
Cho 200ml dung dịch NaOH 8% có D = 1,15g/ml tác dụng với 380 gam dung dịch MgCl2 5%.
Viết PTHH. Chất nào còn dư? Tính khối lượng chất dư.Tính khối lượng kết tủa tạo thành. Sau khi vô hiệu kết tủa, tính C% những chất còn sót lại sau phản ứng.Thế là xong nhé những bạn
Các công thức được chụp bằng hình là
Công thức liện hệ C%, CM , khối lượng riêng D
Công thức tính khối lượng riêng (D)
Nồng độ phần trăm
Công thức tính thành phần phần trăm
Phần trăm theo khối lượng:Phần trăm theo thế tích (đó đó là phần trăm theo số mol):Các công thức hóa học lớp 8, 9 cơ bản cần nhớ
Các công thức hóa học lớp 8 cơ bản cần nhớ gồm có: công thức tính số Mol, công thức tính nồng độ Mol, công thức tính nồng độ %, công thức tính khối lượng, công thức tính thể tích dung dịch…
21 công thức hóa học lớp 8, 9 cần nhớ Các công thức thường gặp
Các công thức thường gặp  Công thức tính khối lượng dung dịch
Công thức tính khối lượng dung dịch  ⚗️ GIA SƯ HÓA
⚗️ GIA SƯ HÓA
Tổng hợp những công thức hóa học lớp 8 cần nhớ – chuyên đề 1
Môn Hóa học lớp 8 ra mắt đến những em những kiến thức và kỹ năng cơ bản nhất của môn Hóa học. Thế nào là chất, thế nào là nguyên tố hóa học. Nguyên tử và phân tử rất khác nhau ở đâu. Song song với đó, những em cũng tiếp tục được học một số trong những công thức hóa học.
Dưới đây là tổng hợp những công thức hóa học lớp 8 cần nhớ thuộc chương thứ nhất: Chất – Nguyên tử – Phân tử – Hóa trị. Cụ thể là những công thức liên quan đến khối lượng nguyên tử, khối lượng phân tử, quy tắc hóa trị của một chất.
1, Tổng hợp những những công thức hóa học lớp 8 cần nhớ – Phần 1: Chất – Nguyên tửKiến thức trọng tâm về Chất
Chất có ở khắp nơi, ở đâu có vật thể, ở đó có chất.
Vật thể do một chất hoặc nhiều chất tạo nên. Ví dụ như ấm nhôm do nhôm tạo nên, xe đạp do những chất sắt, nhôm, cao su tạo nên.
Mỗi một chất lại sở hữu những tính chất vật lí và tính chất hóa học nhất định. Ví dụ như nước sôi ở 100 độ C và đông đặc ở 0 độ C. Đường có vị ngọt, đồng có red color
Hỗn hợp: Hai hay nhiều chất trộn lẫn vào với nhau thì gọi là hỗn hợp. Chú ý rằng, nước tự nhiên gồm nhiều chất trộn lẫn là một hỗn hợp. Còn nước cất là chất tinh khiết
Tách chất ra khỏi hỗn hợp: Dựa vào sự rất khác nhau về tính chất vật lý như tính tan, nhiệt độ sôi của những chất hoàn toàn có thể tách được một chất ra khỏi hỗn hợp
Kiến thức trọng tâm về Nguyên tử
Nguyên từ được định nghĩa là hạt vô cùng nhỏ và trung hòa về điện.
Cấu tạo của nguyên tử gồm có vỏ nguyên tử và hạt nhân nguyên tử
Hạt nhân nguyên tử gồm có 3 loại hạt là hạt proton mang điện tích dương, hạt notron không mang điện và hạt electron mang điện tích âm.
 Mô hình cấu trúc hạt nhân nguyên tử
Mô hình cấu trúc hạt nhân nguyên tử Đặc điểm và công thức hạt nhân nguyên tử
- Nguyên tử trung hòa về điện nên số proton bằng số electron. Ta có công thức p = e. Đây là một trong những công thức hóa học cơ bản thcsElectron luôn hoạt động và sinh hoạt giải trí quanh hạt nhân và sắp xếp thành từng lớpProton và notron có cùng khối lượng. Ta có công thức: m (p) = m (n)electron có khối lượng rất bé không đáng kể, nên khối lượng hạt nhân cũng là khối lượng hạt nhân. Ta có công thức: m (nguyên tử) = m (hạt nhân)
Kiến thức trọng tâm về Nguyên tố hóa học
Nguyên tố hóa học: Là tập hợp những nguyên tử cùng loại, có cùng số proton trong hạt nhân. Mỗi nguyên tố hóa học lại được màn biểu diễn bằng một kí hiệu hóa học. Ví dụ: Na, K, S, Cl, Fe
Nguyên tử khối là khối lượng của một nguyên tử tính bằng đơn vị cacbon. Mỗi nguyên tử có một khối lượng riêng biệt,
Đơn vị cacbon (đvC): 1 đvC = 1/12 m (Cacbon)
Trong số đó khối lượng nguyên tử C – m (Cacbon) = 1, 9926. 10 -23
✅ ĐỀ THI MÔN HÓA HỌC KÌ 1 LỚP 8 ⭐️⭐️⭐️⭐️⭐️ 2, Tổng hợp những những công thức hóa học lớp 8 cần nhớ – Phần 2: Phân tửPhân tử là người đại diện cho chất, gồm một số trong những nguyên tử link với nhau và thể hiện đầy đủ tính chất hóa học của chất
Phân tử có hai dạng là đơn chất và hợp chất
- Đơn chất: là những chất tạo nên từ một nguyên tố hóa học. Khí Hidro (H2) là đơn chất, được tạo nên từ 1 nguyên tố hóa học là hidro. Trong đơn chất lại được phân thành 2 loại là đơn chất sắt kẽm kim loại và đơn chất phi kim. Đơn chất sắt kẽm kim loại có tính dẻo, tính dẫn điện, tính dẫn nhiệt, ánh kim,…Hợp chất: là những chất tạo nên từ hai nguyên tố hóa học trở lên. NaCl là hợp chất, được tạo nên từ 2 nguyên tố hóa học đó là natri (Na) và clo (Cl)
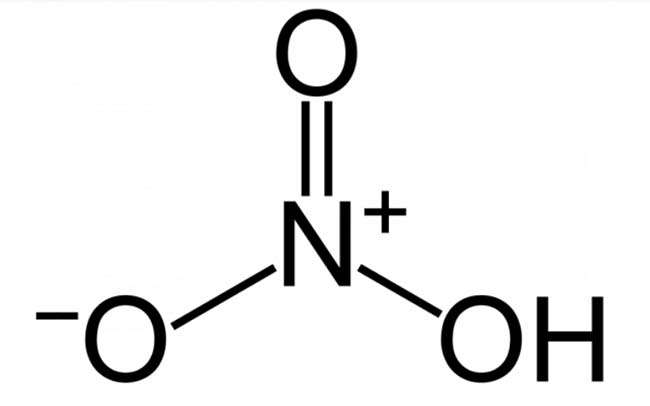 Cấu trúc phân tử axit nitric (HNO3)
Cấu trúc phân tử axit nitric (HNO3) công thức hóa học đầy đủ tính khối lượng phân tử:
Phân tử khối = khối lượng phân tử (đvC) = tổng số nguyên tử nguyên tố . nguyên tử khối
Ví dụ đơn chất: Phân tử ni tơ gồm 2 nguyên tử N. Vậy phân tử khối của ni tơ được tính bằng 2 lần nguyên tử khối của nguyên tử N và bằng 2.14 = 28 (đvC)
Ví dụ hợp chất: Một phân tử axit clohidric (HCl) được cấu trúc từ 1 nguyên tử Hidro (H) và một nguyên tử Clo (Cl). Vậy phân tử khối của axit clohidric được tính bằng tổng của nguyên tử khối của H và Cl và bằng 1 + 35,5 = 36,5 (đvC)
3, Tổng hợp những những công thức hóa học lớp 8 cần nhớ – Phần 3: Công thức hóa họcCông thức hóa học của đơn chất được kí hiệu dưới 2 dạng là A và Ax
- Trong số đó A thường là đơn chất sắt kẽm kim loại với một vài phi kim, ví dụ Na, Fe, Cu, P, C, SCòn Ax thường là đơn chất phi kim, gồm 2 nguyên tử link với nhau: O2, H2, N2
Công thức hóa học của hợp chất có công thức AxByCz
Trong số đó A, B, C là những kí hiệu hóa học còn x, y, z là những chỉ số chân, cho biết thêm thêm số nguyên tử của nguyên tố có trong một phân tử
Ý nghĩa của công thức hóa học: Công thức hóa học của mỗi chất cho biết thêm thêm
- Số nguyên tố tạo ra chấtSố nguyên tử của mỗi nguyên tốPhân tử khối
Ví dụ: axit sunfuric có công thức hóa học là H2SO4
Vậy axit sunfuric do 3 nguyên tố H, S, O tạo ra
Trong 1 phân tử axit sunfuric có 2 nguyên tử H, 1 nguyên tử S và 4 nguyên tử O
Phân tử khối của một phân tử axit sunfuric bằng 2.1 + 1.32 + 4.16 = 98 (đvC)
4, Tổng hợp những những công thức hóa học lớp 8 cần nhớ – Phần 4: Hóa trịHóa trị của một nguyên tố (hay một nhóm nguyên tử) là số lượng biểu thị kĩ năng link của nguyên tử (hay nhóm nguyên tử), được xác định theo
Hóa trị của H, hóa trị của H được chọn làm đơn vị, hóa trị của H là một trong đơn vị
Hóa trị của O là 2 đơn vị
Quy tắc hóa trị: AxBy -> a.x = b.y
Đây là công thức hóa trị cơ bản nhất, từ công thức này, ta có những công thức hóa học lớp 9 liên quan đến hóa trị sau này
Trong số đó
a, b là hóa trị của nguyên tố.
x, y là chỉ số hay số nguyên tử của nguyên tố
5, Bài tập vận dụng một số trong những những công thức hóa học lớp 8 cần nhớBài tập 1: Tổng số hạt proton, notron, electron trong nguyên tử là 28 hạt, trong đó số hạt không mang điện là 10. Tính số hạt mỗi loại
Hướng dẫn giải
Hạt không mang điện là notron, vậy n = 10
Tổng số hạt proton, notron và electron trong nguyên tử là 28 nên ta áp dụng những công thức hóa học lớp 8 cần nhớ có p + n + e = 28 (1)
Vì số proton bằng số electron nên từ (1) ta có 2p + n = 28, mà n = 10 nên ta có số p = số e = 9
Vậy ta có số hạt proton và electron là 9, số notron là 10
Bài tập 2: a) Tính phân tử khối của mỗi chất sau: axit nitric, canxi sunfat, sắt III oxit, bari hidroxit
b) xác định % khối lượng của oxi trong mỗi phân tử trênHướng dẫn giải
a) axit nitric: HNO3 có phân tử khối là M = 1 + 14 + 3.16 = 63 (đvC)canxi sunfat: CaSO4 có phân tử khối là M = 40 + 32 + 4.16 = 120 (đvC)
sắt III oxit: Fe2O3 có phân tử khối là M = 56.2 + 16.3 = 160 (đvC)
bari hidroxit Ba(OH)2 có phân tử khối là M = 137 + 2.(16+1) = 171 (đvC)
b) % Oxi trong axit nitric là: 3.16 / 63 = 76,19%% Oxi trong canxi sunfat là: 4.16 / 120 = 53,33%
% Oxi trong sắt III oxit là: 16.3 / 160 = 30%
% Oxi trong bari hidroxit: 32 / 171 = 18,71%
Trên đây là toàn bộ những công thức hóa học lớp 8 cần nhớ liên quan đến chương thứ nhất của hóa học lớp 8: Chất – Nguyên tử – Phân tử – Hóa trị. Để hoàn toàn có thể làm được những bài tập của phần này, những em học viên cần nắm được những công thức tổng hợp trong bài cũng như xem kĩ lại những bài tập ví dụ đã được giải rõ ràng phía trên.
✅ PHƯƠNG PHÁP HỌC TỐT MÔN HÓACông thức hóa học | Bài tập lập công thức hóa học nếu biết hóa trị
Lập công thức Hóa Học là một trong nhiều dạng bài cơ bản khi tham gia học môn Hóa Học lớp 8 được bố trí theo hướng dẫn giải đầy đủ. Chúng ta cần nắm được cách làm và một số trong những lưu ý rất quan trọng thì lập công thức hóa học nhanh, đúng chuẩn rất nhiều
1. Lập công thức của đơn chất
Lập công thức hóa học của Kim loạiCông thức hóa học được phân thành nhiều chủng loại như công thức hóa học của sắt kẽm kim loại thường trùng với ký hiệu hóa học của sắt kẽm kim loại đóVí dụ:Công thức hóa học của Natrium là NaCông thức hóa học của Kalium là KCông thức hóa học của Canxium là Ca
Công thức hóa học của Sắt là Fe
Lập công thức Hóa Học của Phi kimCông thức hóa học của phi kim thường tồn tại ở dạng khí nên khi thể hiện trên công thức hóa học tất cả chúng ta thường có hai nguyên tử của nguyên tố phi kim link với nhauVí dụ:Công thức hóa học của Hidro là H2Công thứ hóa học của Clo là Cl2Công thức hóa học của Nitơ là N2Công thức hóa học của Oxy là O2Một số quy ước khác, công thức hóa học phi kim cũng hoàn toàn có thể là ký hiệu hóa họcVí dụ:Công thức hóa học của Cácbon là CCông thức hóa học của Phốt pho là PCông thức hóa học của hợp chất
Công thức hóa học của Lưu huỳnh là S
2. Lập công thức của hợp chất
Hợp chất hóa học là hỗn hợp được tạo nên là hai hoặc nhiều nguyên tố hóa học rất khác nhau.Khi tất cả chúng ta lập công thức của hợp chất hóa học tất cả chúng ta nên phải nắm vững được quy tắc hóa trị.Hóa trị là gì?
Hóa trị là của một nguyên tố được xác định bằng số link hóa học mà một nguyên tử của nguyên tố đó tạo nên trong phân tử
Quy tắc hóa trị là gì ?Xét một hợp chất hóa học có công thức tổng quát

3. Bài tập lập công thức Hóa Học
Bài 1: Lập công thức Hóa Học của những hợp chất sau đây:
a. Lập công thức hóa học của Cu(II) và Clo tạo thành hợp chất Đồng Clorua[CuCl2]Bài giải:
– Gọi công thức tổng quát của hợp chất là
Theo quy tắc hóa trị ta có: 2x=y
Chọn x=1, y=2 ta được công thức hóa học của đồng clorua là
b. Lập công thức hóa học giữa Al và (NO3) tạo thành chất Nhôm Nitơrát [Al(NO3)3]Bài giải:
– Gọi công thức Hóa Học của hợp chất là
– Theo quy tác hóa trị ta có: 3x=y
Chọn x=1, y=3 ta được công thức hóa học của Nhôm Nitơrát là
c.Lập công thức hóa học của Canxi Phốt phát chứa nguyên tố Ca và nhóm phốt phát (PO4) có số hóa trị là 3Bài giải:
– Gọi công thức hóa học của hợp chất là
– Theo quy tắc hóa trị ta có: 2x=3y
Chọn x=3, y=2 ta được công thức Hóa học của Canxi photphat là
Bài 2: Lập công thức hóa học của sắt có hóa trị tương ứng trong công thức FeCl2 với nhóm (OH) có hóa trị I.
[embed]https://www.youtube.com/watch?v=LUlQbR_H9cY[/embed]




